Medicamento Elevidys é suspenso nos EUA após mortes e Anvisa diz que decisão não afeta o Brasil
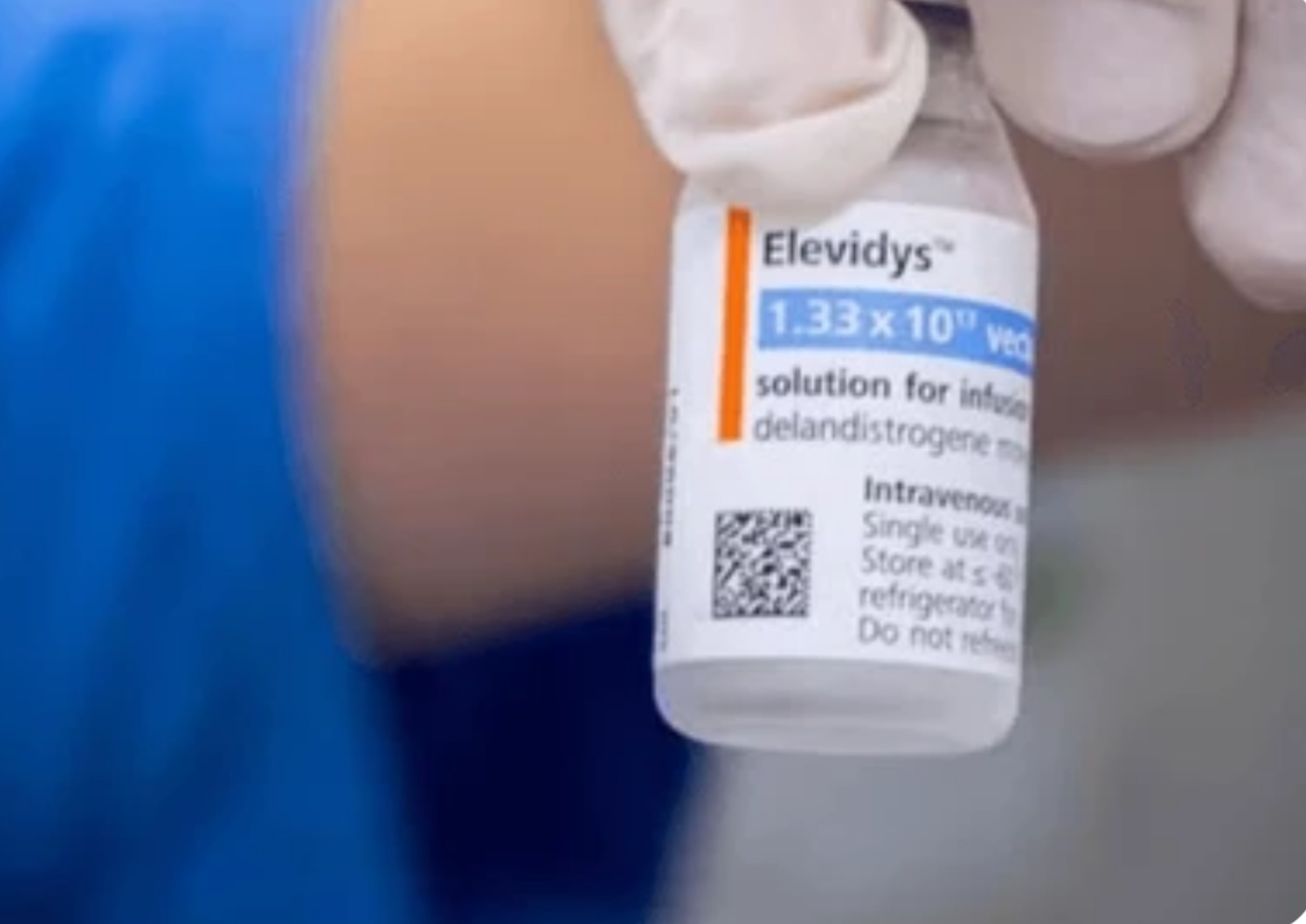
A morte de dois adolescentes nos Estados Unidos levou à suspensão do uso do remédio, a primeira terapia gênica aprovada para o tratamento da distrofia muscular de Duchenne (DMD), no país. A decisão se aplica a pacientes que não conseguem mais andar (não deambuladores).
No entanto, segundo a Agência Nacional de Vigilância Sanitária (Anvisa), o uso do medicamento segue autorizado no Brasil com restrições rigorosas, e o público afetado pela suspensão nos EUA já não era elegível à terapia no país.
Desenvolvido pela empresa norte-americana Sarepta Therapeutics e comercializado globalmente pela Roche, o Elevidys teve sua aplicação suspensa em pacientes não deambuladores após dois casos fatais de insuficiência hepática aguda registrados em jovens de 15 e 16 anos.
Em nota, a Anvisa afirmou que acompanha o caso e mantém monitoramento contínuo. A agência ressaltou que, no Brasil, o Elevidys só pode ser usado em crianças de 4 a 7 anos que ainda conseguem andar.
“A suspensão promovida nos Estados Unidos refere-se exclusivamente a pacientes não deambuladores – população para a qual o produto não está aprovado no Brasil”, informou a Anvisa.
A Roche se posicionou dizendo que a bula aprovada para o Brasil segue inalterada, “uma vez que não está aprovado o uso em pacientes não deambuladores”.
“A Roche está trabalhando em estreita colaboração com as autoridades de saúde relevantes (como Anvisa e Ministério da Saúde), e médicos prescritores para garantir que estejam informados. Vale ressaltar que os mesmos receberam comunicados e informativos no último dia 15”, completa a nota da farmacêutica.
Por que foi suspenso nos EUA?
A autorização para uso do Elevidys em pacientes que já não andam foi concedida pela FDA (agência reguladora dos EUA) em 2023 sob o modelo de aprovação acelerada, que permite o uso de terapias inovadoras mesmo com dados clínicos ainda limitados, desde que não existam opções alternativas.
Os óbitos ocorridos – um em março e outro em junho de 2024 – envolveram jovens participantes de estudos clínicos dentro desse regime. Diante disso, a Sarepta optou por suspender temporariamente o uso nessa população e notificou autoridades reguladoras de outros países.
O que é a distrofia muscular de Duchenne?
A distrofia muscular de Duchenne é uma doença genética rara e grave que atinge principalmente meninos e causa a degeneração progressiva dos músculos.
Os primeiros sintomas, como fraqueza muscular nas pernas e dificuldade para correr ou subir escadas, geralmente aparecem entre os 3 e 6 anos de idade. A doença avança rapidamente: muitos pacientes perdem a capacidade de andar na adolescência e podem desenvolver insuficiência cardíaca ou respiratória na juventude.
A causa da DMD está na mutação do gene que produz a distrofina, uma proteína essencial para a integridade dos músculos. Sem ela, o tecido muscular se desgasta progressivamente. Ainda não existe cura, mas terapias como o Elevidys buscam retardar o avanço da doença.
Como funciona o Elevidys?
Trata-se de um tratamento de dose única, administrado por via intravenosa, que utiliza um vetor viral para levar ao organismo um gene modificado que instrui o corpo a produzir a microdistrofina, uma versão funcional e reduzida da proteína distrofina.
O objetivo é restaurar parcialmente a função muscular, principalmente em pacientes na fase inicial da doença. A eficácia a longo prazo ainda está sendo avaliada em estudos clínicos, especialmente nos grupos mais debilitados.
O remédio também chama atenção pelo custo: é um dos medicamentos mais caros do mundo. Nos Estados Unidos, custa cerca de US$ 3,2 milhões. No Brasil, seu preço foi fixado pela Câmara de Regulação do Mercado de Medicamentos (CMED) em até R$ 20 milhões por dose – o mais alto já aprovado no país.
Da 93Notícias